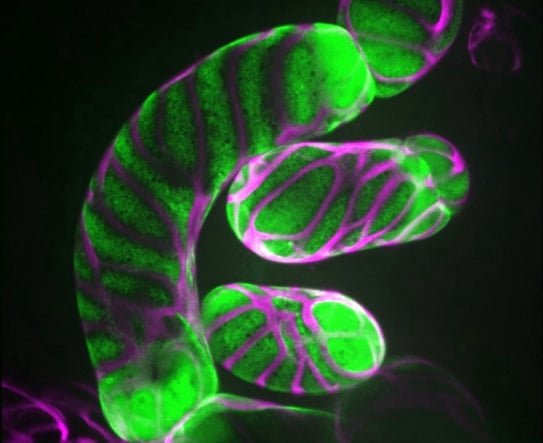
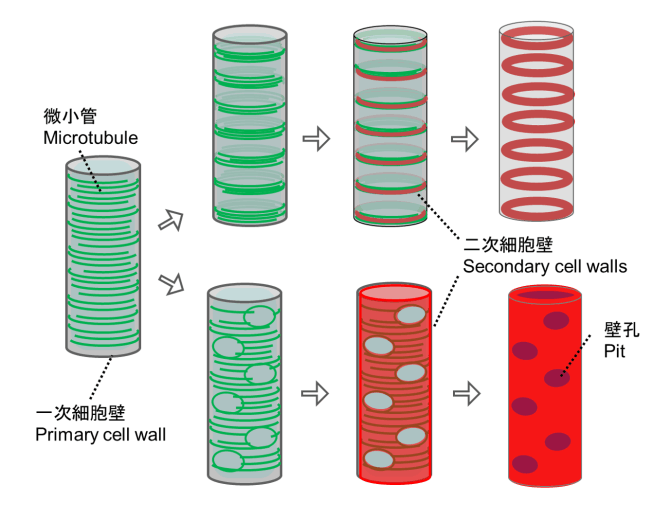
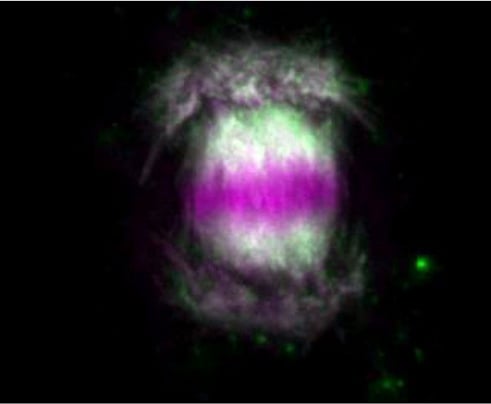
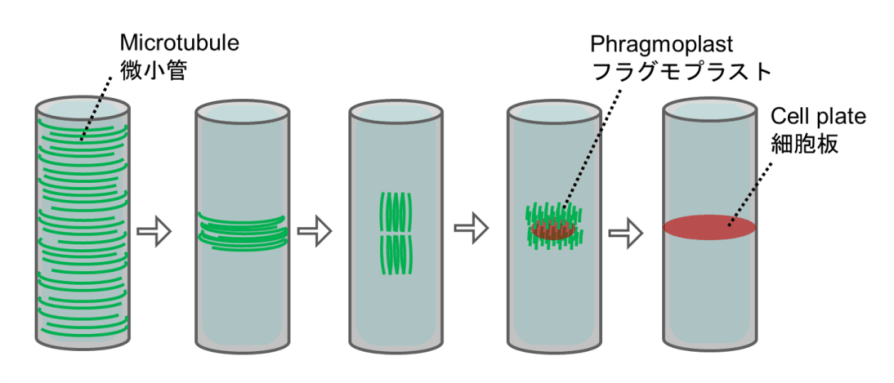
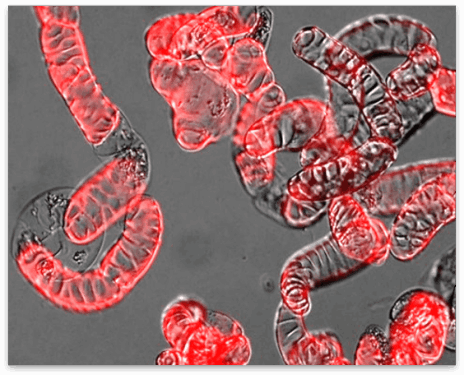
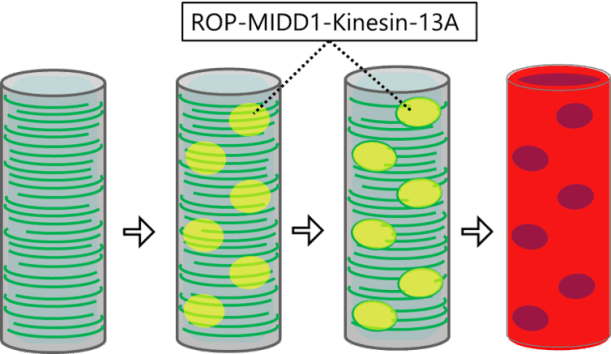
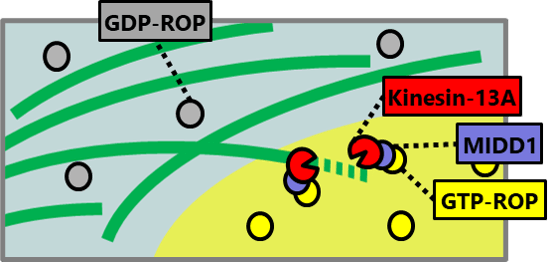
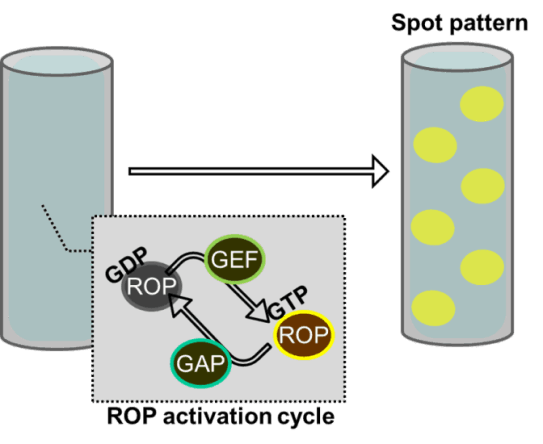
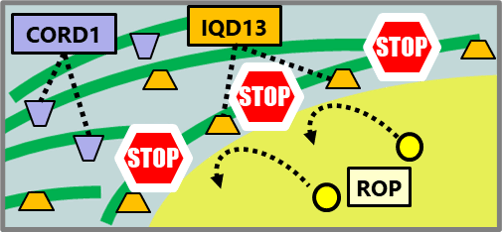
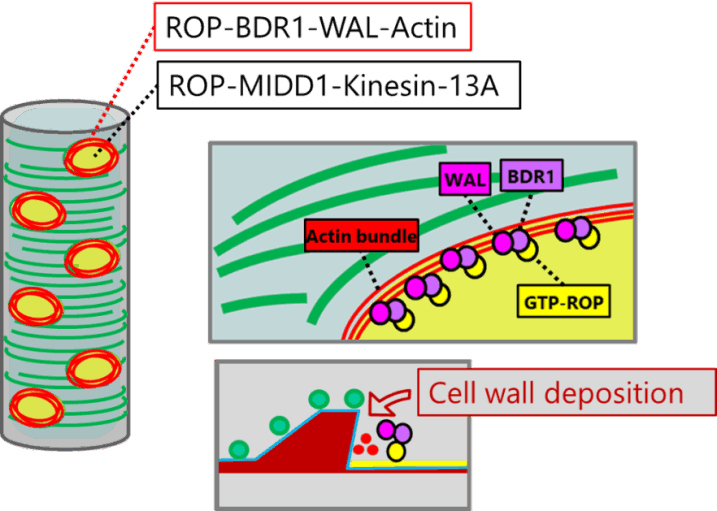
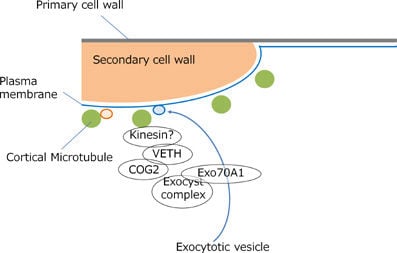
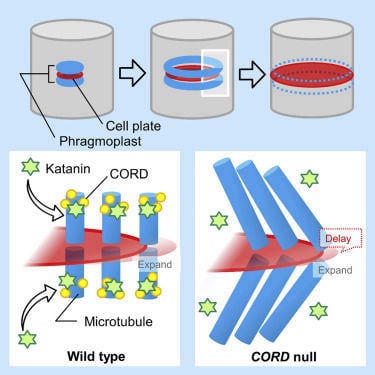
植物細胞の細胞壁は様々な成分で構成される複雑なマトリックスです。その主成分であるセルロース微繊維はたがとなって細胞の伸長を抑制するため、その並び方が細胞の形態を決定付けます。細胞膜直下に並ぶ微小管は細胞膜中に埋め込まれたセルロース合成酵素の軌道を誘導することにより、セルロース微繊維の並び方を決定しています。これらの微小管は細胞の状態に応じてダイナミックかつ秩序立って分布を変えることにより、細胞壁の沈着パターン、さらには細胞のかたちを制御しています。微小管の位置や方向はいったいどのようにして制御されているのでしょうか?